Membres















À propos
Comment les sentinelles du système immunitaire traduisent-elles les signaux microbiens et de danger qu’elles reçoivent en instructions immunologiques ?
Dans le sang, les muqueuses et les organes lymphoïdes, les cellules dendritiques jouent un double rôle, elles sont à la fois des sentinelles et des chefs d’orchestre du système immunitaire. Cachées aux points d’entrée utilisés par les pathogènes, elles localisent les agents infectieux, les ingèrent et libèrent des signaux biochimiques pour alerter les différentes lignes de défense du corps et attirer des cellules anti-microbiennes vers le site de l’infection. Une fois l’intrus digéré, les cellules dendritiques exposent à leur surface des fragments du pathogène : les antigènes. Elles migrent ensuite via les voies lymphatiques vers les organes lymphoïdes secondaires (rate, ganglions lymphatiques, tissus lymphoïdes associés aux muqueuses du tractus digestif et des poumons) où elles présentent ces antigènes aux lymphocytes T et B. Une fois les caractéristiques du pathogène identifiées, ces cellules munis d’un armement adapté et précis migrent à leur tour vers le site de l’infection pour en assurer l’éradication à long terme.
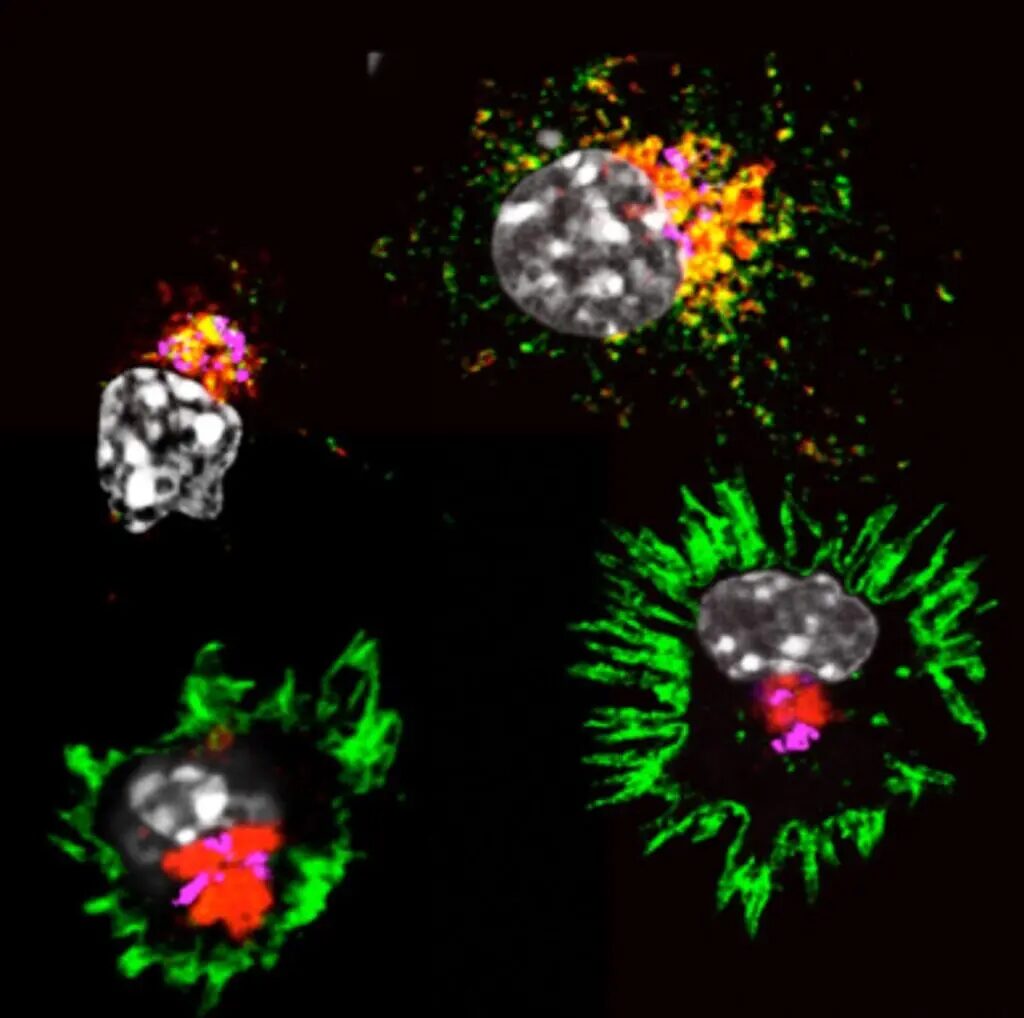
Images confocales montrant l’activation des cellules dendritiques durant 24h (molécules du CMH II en vert, lysosomes en rouge, noyaux en gris). Image courtoisie d’Alexis Combes, CIML.
Le Laboratoire de Biologie des Cellules Dendritiques (DeCiBeL) s’engage à approfondir la compréhension et à développer des outils innovants pour étudier la biologie cellulaire et moléculaire des cellules dendritiques (DCs) et d’autres phagocytes, en conditions normales et pathologiques. Nos recherches portent sur les voies impliquées dans l’identification des motifs moléculaires associés aux microbes (MAMPs). Ces voies orchestrent divers processus cellulaires, notamment l’inflammation, l’autophagie, le transport intracellulaire, le stress du réticulum endoplasmique (ER) et le métabolisme énergétique, pour activer efficacement les cellules immunitaires. L’autophagie et le stress du ER, en particulier la réponse aux protéines mal repliées (UPR), sont essentiels pour réguler le métabolisme cellulaire et peuvent lier l’inflammation à des déclencheurs environnementaux dans les maladies auto-immunes et le cancer.
Nous étudions ces voies et la régulation de la synthèse des protéines pour mieux comprendre comment ces processus internes adaptent la biochimie et le métabolisme des DCs à différents signaux environnementaux microbiens ou de danger (MAMPs et DAMPS). Les interconnexions complexes entre ces voies nécessitent nouvelles méthodes quantitatives de haute résolution, au développement desquelles notre laboratoire contribue régulièrement. Ces innovations visent à approfondir notre compréhension de la manière dont les DCs acquièrent leurs fonctions immuno-régulatrices distinctives, avec des implications pour les applications cliniques en cancérologie et dans les maladies auto-immunes.
Des informations précises sur les différents projets de l’équipe en cours peuvent être trouvé dans les pages spécifiques dédiées aux projets, en plus de la description succincte présentée ci-dessous.
Déchiffrer les interactions entre l’ISR et la détection des PAMPs.
P. Pierre (coordinateur) avec le soutien de tous les chercheurs permanents.
Le stress du RE induit la réponse aux protéines mal repliées (UPR), via l’activation de plusieurs capteurs, y compris la kinase PERK (eIF2AK3) située dans le réticulum endoplasmique (ER), qui, par phosphorylation de sa cible eIF2a, réduit la synthèse des protéines et établit un programme biochimique favorisant la résolution du stress et la survie cellulaire, la réponse intégrée au stress (ISR). Nos recherches ont montré que les DCs présentent des niveaux inhabituellement élevés de phosphorylation du facteur de traduction eIF2a acquis durant leur différentiation cellulaire. La phosphorylation d’eIF2a principalement médiée par l’activité de PERK activée dans les DCs, mais sans signes apparents d’UPR active (Mendes et al. 2022). Ce processus a un faible impact sur les niveaux de synthèse des protéines et rend les DCs relativement résistantes à des agents induisant le stress du ER, comme la cytotoxine Subtilase (SubAB). Nous avons également montré que PERK régule la migration cellulaire et est essentielle pour répondre à la détection des MAMPs. De manière surprenante, la stimulation de PERK par SubAB induit l’expression d’Interferon de type-I dans les DCs plasmacytoïdes (pDC), pouvant aussi agir en synergie avec la stimulation du récepteur Toll-like 7 (Barros et al. 2025). L’induction d’IFN en réponse à SubAB seul repose sur l’activation du STimulator of Interferon Genes (STING) couplée à l’inhibition de la synthèse protéique médiée par PERK. En bloquant la traduction des mARNm via l’ISR, SubAB précipite la diminution des régulateurs de rétrocontrôle négatif du signalement inné, nécessaires pour libérer la signalisation TBK1 associée à l’activation de STING.
Ces résultats, ainsi que l’identification de mutations dans d’autres gènes eIF2AK chez des familles de patients susceptibles à l’auto-immunité ou l’auto-inflammation, soulignent l’importance de l’ISR dans l’auto-immunité humaine. En particulier, la découverte d’un patient atteint de SAVI présentant des mutations dans les gènes Sting1 et Perk et affichant des symptômes inhabituels pour cette interféronopathie (de Cevin et al. 2023), met en évidence la pertinence de mieux comprendre les échanges entre l’ISR et l’immunité innée.
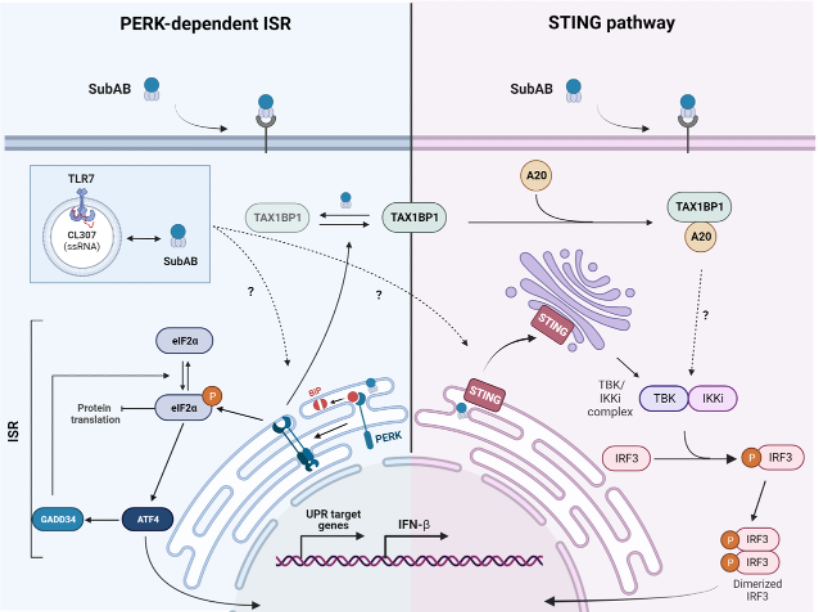
SubAB induit la production d’IFN de type I via l’activation de STING et la perte du régulateur négatif de rétrocontrôle TAX-1BP1, qui est diminué lors de l’arrêt de la synthèse protéique.
Pour faciliter nos études, nous avons établi une base de données web accessible (MetamORF, https://metamorf.hb.univ-amu.fr) pour identifier les gènes uORF/régulés par l’ISR (en collaboration avec C. Brun, TAGC Marseille, Choteau et al. 2022). Nous avons aussi développé une nouvelle méthode basée sur la cytométrie de flux (SNUPR, co-coordination avec RJ. Argüello) pour suivre simultanément l’activation des trois branches de l’UPR. SNUPR s’est révélée être un outil précieux pour détecter l’importance de la branche IRE-1 dans l’acquisition de la résistance au Bortézomib par les cellules cancéreuses de myélome multiple (Gigan et al. 2024).
Dynamiques des endomembranes dans la détection et la signalisation immunitaires innées et adaptatives.
E. Gatti (coordinateur), avec le soutien de tous les chercheurs permanents.
La détection des MAMPs impacte l’organisation des organites membranaires, et en particulier l’endocytose afin de permettre aux cellules dendritiques d’acquérir efficacement leurs fonctions immuno-stimulatrices. Nous avons montré que la protéine BAD-LAMP/LAMP5 est principalement présente dans les pDC humaines et dans les néoplasmes blastiques de pDC (BPDCN), et contrôle le transport de TLR9 vers les endosomes de signalisation (Combes et al., Nat Com. 2017). Nos résultats indiquent aussi que BAD-LAMP est exprimée dans les cellules leucémiques MML issues de patients, où elle maintient la survie cellulaire et la progression du cancer via l’activation de la signalisation NF-kB (Maldonado et al. 2022).
Parallèlement, nous poursuivons l’étude du rôle des protéines RUFY dans les phagocytes (Char et al. 2020). La famille RUFY se caractérise par un domaine RUN, qui interagit avec les petites protéines liant le GTP, et un domaine FYVE, impliqué dans la reconnaissance des lipides PtdIns(3)P dans les organites. Outre la régulation de l’autophagie dans les DC, notre étude suggère un rôle de RUFY4 dans l’élimination sélective des mitochondries dans les macrophages alvéolaires via des effecteurs comme PLEKHM1, Rab7, le complexe HOPS et différentes protéines mitochondriales (Valecka et al. 2022). Nous avons aussi démontré qu’un isoforme spécifique des cellules immunitaires de RUFY3 participe au regroupement des lysosomes dans les macrophages et DCs en réponse au LPS bactérien (Char et al. 2023). Dans l’ensemble, RUFY3 joue un rôle régulateur dans la signalisation de l’IFN-g, la présentation antigénique et la migration, et possède un rôle anti-inflammatoire in vivo. RUFY3 interagit avec la petite GTPase ARL8b, qui contrôle le transport des endosomes tardifs médié par la dynéine le long des microtubules en relation avec la formation de lipides PtdIns(3)P par la PI3 kinase de classe III, Vps34. Dans un projet parallèle, nous avons aussi confirmé que l’inhibition pharmacologique de VPS34 interfère avec la distribution de RUFY3, mais également avec la signalisation des TLR7/9.
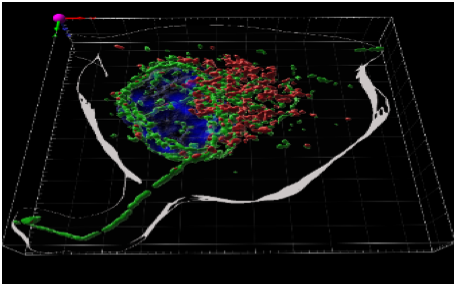
Image confocale montrant la distribution de RUFY3 (vert) sur des tubules émanant des endosomes tardifs (Lamp1, rouge) dans une situation ou le PtdIns(3)P s’accumule dans les macrophages. Image courtoisie de Rémy Char, CIML
Régulation Métabolique de l’Immunité.
Rafael J. Argüello (Coordinateur)
Nous visons à élucider comment les processus métaboliques régulent les réponses immunitaires dans les cellules myéloïdes humaines, notamment les DCs, les macrophages et les monocytes, dans les contextes de cancer et de sepsis. Notre laboratoire a développé SCENITH, une méthode pionnière basée sur la cytométrie en flux permettant le profilage métabolique à l’échelle cellulaire. Cette innovation, détaillée dans notre publication (Argüello* et al., Cell Metabolism, 2020), est devenue une pierre angulaire pour les études métaboliques des cellules immunitaires, accumulant plus de 400 citations. D’autres avancées méthodologiques incluent SunRiSE, évaluant les vitesses d’élongation de la traduction en cellule unique, et récemment SNUPR (Gigan et al. 2024), permettant des analyses mono-nucléaires de la réponse aux protéines mal repliées. Ces outils ont considérablement amélioré notre compréhension de la régulation métabolique et protéostatique dans les cellules immunitaires, mettant particulièrement en évidence les changements métaboliques associés aux états pathologiques. Nous avons récemment introduit une adaptation de SCENITH adaptée aux échantillons de sang fixés et stabilisés, sa compatibilité avec le tri et l’analyse épigénomique, élargissant ainsi son application pour les futures études cliniques. Nos études ont également révélé des vulnérabilités métaboliques dans la leucémie, soulignant comment les adaptations mitochondriales contribuent à la résistance aux thérapies (Bosc et al., 2021). D’autres résultats ont identifié des états métaboliques régissant la différenciation des cellules dendritiques inflammatoires et tolérantes, influençant la modulation immunitaire et les résultats des patients (Adamik et al., Nat Commun, 2022).
Réponse des cellules dendritiques aux ARNm de vaccins modifiés.
Béatrice Nal-Rogier (Coordinateur) avec le soutien de tous les chercheurs permanents.
Description : L’impact des ARNm finement adaptés sur la recherche et la science de la santé devrait être immense. La conception et la mise sur le marché rapide du vaccin à ARNm Spike du SARS-CoV-2 au cours des dernières années de pandémie ont illustré la nouveauté et la puissance de l’approche, tout en soulignant des améliorations corrélées visant, par exemple, une meilleure tolérance/effets secondaires et une meilleure conservation à température ambiante. Nous étudions l’impact des méthylations de l’ARNm par de nouvelles méthyltransférases conçues par IA sur la stabilité de l’ARNm, la traduction des protéines et les voies moléculaires dans les DC humaines. Nos partenaires à l’AFMB et l’IGF concevront et produiront de nouvelles méthyltransférases d’ARNm, qui seront évaluées en laboratoire pour leur efficacité de traduction et l’induction des réponses immunitaires innées (IFN-I/III, cytokines pro-inflammatoires), la réponse au stress intégrée (ISR) et la présentation antigénique.
Le laboratoire DeCiBeL.
Par son travail et l’établissement de nombreuses collaborations internationales, notre équipe s’efforce de mieux comprendre comment chacune des voies décrites ci-dessus fonctionne et interagit pour mener à une réponse immunitaire efficace. Nous ambitionnons aussi d’identifier quelles en sont les molécules effectrices principales, afin de pouvoir manipuler ces voies en utilisant de la pharmacologie ciblée ou de la génétique correctrice. Le but des ces interventions étant de réduire l’hyperactivité du système immunitaire qui cause des maladies auto-immunes ou, inversement, d’améliorer l’efficacité de la stimulation des DCs pour susciter une réponse immunitaire puissante contre les maladies infectieuses et le cancer.
Projets
Project : UNFIRE Autres participants: Ciphe (Ana Zarubica), Hospices Civils de Lyon et CIRI (Sophie Trouillet-Assant, Thierry Walzer), équipe CoVir […]





The integrated stress response (ISR) is a cellular pathway activated by various biochemical triggers. It reduces global protein synthesis while […]

Project : IMPACT Sensors Other participants : IGBMC, Strasbourg (Nicolas Charlet-Berguerand) and Institut Curie, Paris (Franck Perez). Duration 2025 – […]

Partner : University of Milan, Italy ( Prof. Angelo Poletti , DISFEB) Frameshift mutations in HSPB8 cause neuromyopathies by disrupting […]

CNRS – University of Melbourne Graduate Research Projects The project investigates the molecular interplay between the E3-ubiquitin ligase MARCH1 and […]

Duration: 2021–2025.Partners & funding amounts: APHM/La Timone (E. Tabouret); amount for team: 325 k€.Responsibilities: PI–coordinator (only beneficiary)Theme & content of […]

Bone marrow metabolic niches regulate hematopoiesis (MetaNiche, ANR-22-CE15-0015-02). Duration: 2023–2027 (42 months).Partners & funding amounts: Institut Curie (L. Perié), Institut […]

Full title & acronym: Biomarkers established to stratify sepsis long-term adverse effects to improve patients’ survivorship (BEATsep).Duration: 2024–2029 (60 months).Partners […]

Full title & acronym: Understanding lipid immunometabolism to treat disease (UNLIMITED).Duration: 2025–2029 (48 months).Partners & funding amounts: Consortium led by […]

Anti-GD3 CAR-NK cells to overcome therapeutic resistance in glioblastoma (CARaïbes). Type: National.Duration: 2025–2029 (48 months).Partners & funding amounts: INP-APHM (E. […]

Targeting intratumor metabolic heterogeneity in neuroblastoma to develop innovative treatments (IMAGINe) Type: National.Duration: 2024–2029 (48 months).Partners & funding amounts: CRCM […]

Targeting acute myeloid leukemia immunosuppressive microenvironment by combined IDO1 inhibition and PD-1 blockade Type: European.Duration: 2023–2027 (36 months).Partners & funding […]

South-Research On Cancer for Kids. INCA Pediacriex (France) Type: National (integrated cancer site).Full title & acronym: South-Research On Cancer for […]

Tailoring CAR T-cell metabolism and activation to enhance therapeutic efficacy (CARma) Type: National.Duration: 2025–2029.Partners & funding amounts: CRCM (R. Lasserre); […]