À propos
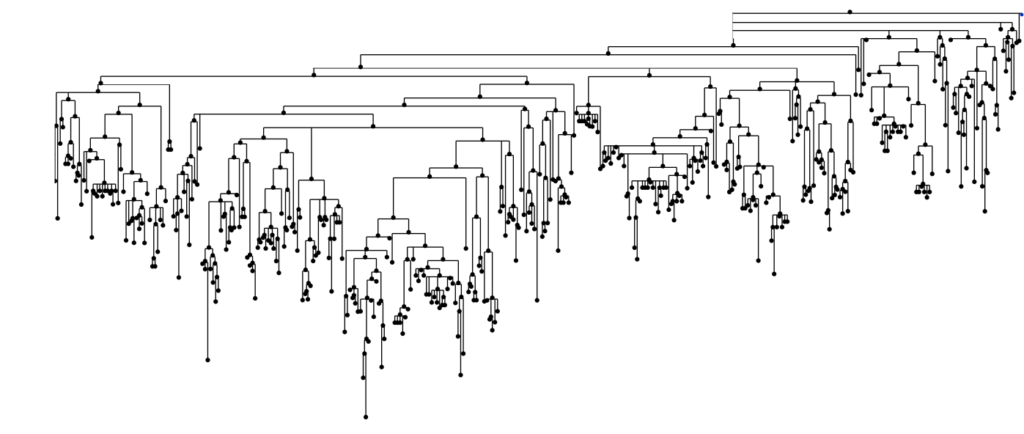
Pour reconnaître et réagir contre des protéines inconnues, les lymphocytes B et T expriment des récepteurs uniques, générés aléatoirement et capables d’évoluer pour affiner leur spécificité. Ces récepteurs forment le répertoire immunitaire, une bibliothèque dynamique et hautement diversifiée, propre à chaque individu. Le séquençage de ces gènes permet aujourd’hui de cartographier ce répertoire, qui renseigne à la fois sur l’histoire immunologique de l’individu et sur ses capacités de réponse future.
Mais l’analyse du répertoire reste un défi majeur : chaque être humain possède 10^{11} récepteurs uniques, dont une majorité qui lui sont exclusifs. Surtout, les interactions entre ces récepteurs et leurs antigènes cibles sont complexes avec les outils actuels. De fait, l’immense majorité des couples anticorps-antigènes sont inconnus, une véritable “matière noire” immunologique, que notre équipe s’attache à éclaircir en combinant méthodes expérimentales et computationnelles.
Des méthodes expérimentales pour mesurer les interactions : Notre équipe développe des technologies haut débit, alliant séquençage et biologie moléculaire, pour quantifier les affinités entre des milliers d’anticorps et leurs cibles potentielles. Ces approches permettent d’identifier les antigènes reconnus, de découvrir des anticorps d’intérêt thérapeutique ou diagnostique, et d’étudier la maturation d’affinité, l’évolution des anticorps.

Des modèles computationnels pour déchiffrer le répertoire En parallèle, nous concevons des modèles statistiques pour analyser la diversité des répertoires, prédire les récepteurs actifs contre une cible donnée, et simuler leur évolution. En intégrant données expérimentales et théories issues de la physique et de la génétique des populations, nous cherchons à comprendre les règles de la reconnaissance immunitaire et à générer des répertoires virtuels permettant de tester des hypothèses.