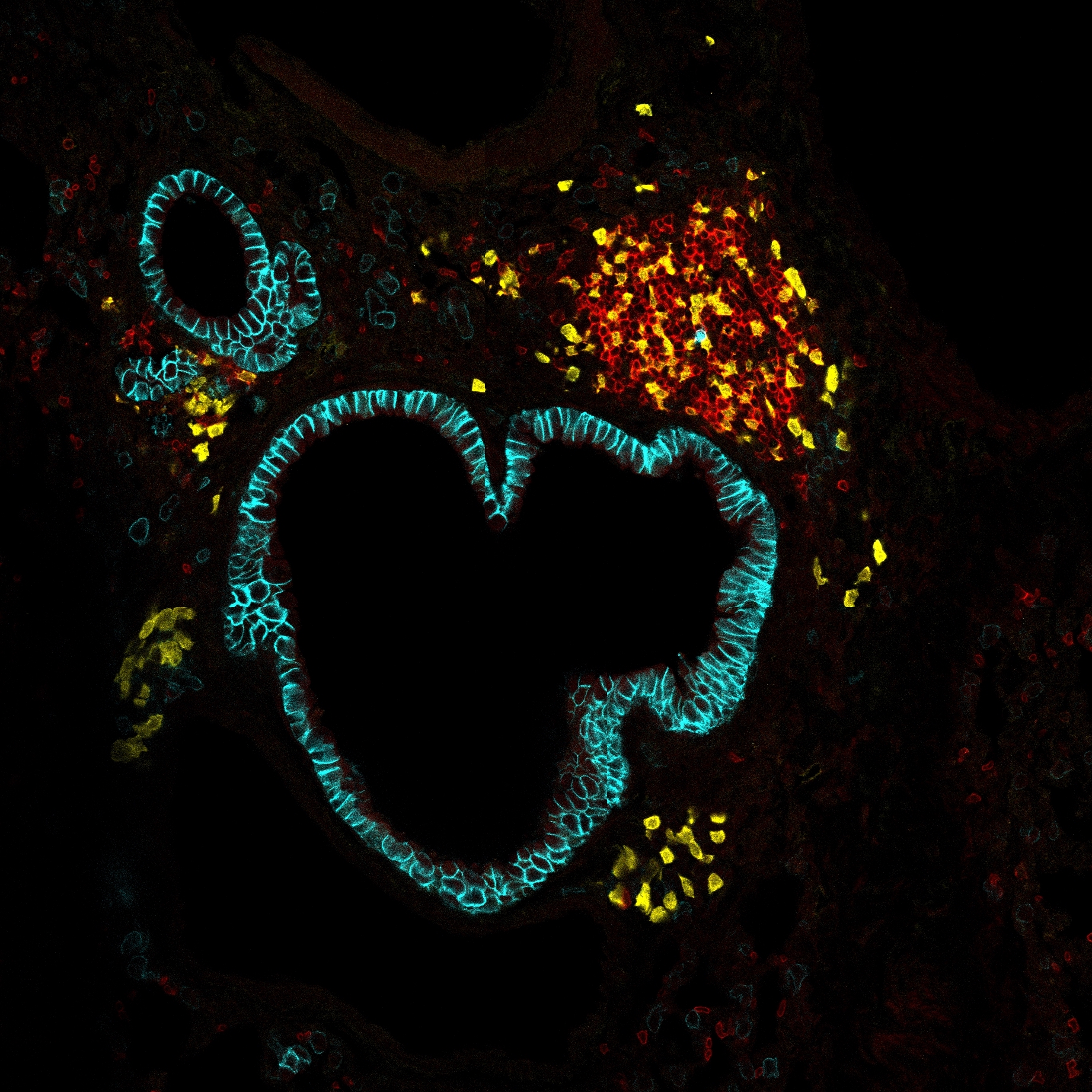
Publication: The brain circuits controlling the immunosuppressive response to the pro-inflammatory cytokine IL1ß Les circuits neuronaux qui contrôlent la réponse immunosuppressive induite par la cytokine pro-inflammatoire IL-1ß
Publié dans: Immunology. Université Paris Cité, 2021. English. ⟨NNT : 2021UNIP7288⟩
Auteurs: Ferdinand Jagot
Résumé
Infections are controlled by the combined actions of the immune system and the brain. The coordination of immune responses, which lead to local and/or systemic inflammation, is mediated by cytokines, which are also effectively sensed by the brain. Cytokines induce a brain response characterized by sickness behaviors such as fever, anorexia and lethargy, and physiological outputs including the activation of the hypothalamo-pituitary-adrenal (HPA) axis leading to corticosterone (CS) release into the blood. The CS response, which is controlled by neurons in the paraventricular nucleus (PVN) of the hypothalamus, is essential to prevent runaway immune responses induced by excessive inflammation. The aim of my thesis was to determine the brain circuits linking systemic immune responses with the induction of the CS response by the brain. We first screened the brain effects of different pro-inflammatory cytokines injected into the peritoneum of mice, and found that the pro-inflammatory cytokine interleukin 1 beta (IL-1ß) is the most efficient to activate the CS response. Together with the PVN, the parabrachial nucleus (PB), an important hub in the brainstem linking interoceptive afferent information to metabolic and behavioral outputs, was strongly activated by IL-1ß. We found that activation of the PB is sufficient to induce the CS response via a subpopulation of PB neurons, controlled by the vagal complex (VC), and directly projecting to the PVN. We propose a mechanism independent of the vagus nerve and the spinoparabrachial pathway, by which VC neurons directly sense circulating IL-1ß and activate the PB via perivascular cells in the area postrema (AP) producing prostaglandins (PGs). Alongside the AP, we found that vascular leptomeningeal cells (VLMCs) of the median eminence, the capillary system containing the axon terminals of PVN neurons, directly respond to IL-1ß. Single-cell analyses revealed that transient activation of VLMCs by IL-1ß in vivo induces the expression of pro-inflammatory mediators, including chemokines and PGs. Due to the close proximity of VLMCs with the axon terminals of PVN neurons controlling the CS response, VLMC may participate in the fine-tuning of the CS response. My thesis work shows that different brain pathways and cellular actors are implicated in the control of the CS response to systemic cytokines. This opens new avenues for therapeutic targets to manipulate the immunosuppression mediated by the brain in conditions of systemic infection, or, on the contrary, in the context of autoimmunity.
Les infections sont contrôlées par les actions combinées du système immunitaire et du cerveau. Le développement de réponses immunitaires, conduisant à une inflammation locale et/ou systémique, est médié par les cytokines, celles-ci pouvant être détectées par le cerveau. Les cytokines induisent une réponse cérébrale caractérisée par des comportements de maladie tels que la fièvre, l’anorexie et la léthargie, ainsi que par des effets physiologiques, notamment par l’activation de l’axe hypothalamo-hypophyso-surrénalien, qui entraîne la libération de corticostérone (CS) dans le sang. La réponse CS, qui est contrôlée par les neurones du noyau paraventriculaire (PVN) de l’hypothalamus, est primordiale pour freiner les réponses immunitaires incontrôlées induites par une inflammation excessive. L’objectif de ma thèse était de déterminer les circuits cérébraux reliant les réponses immunitaires systémiques à l’induction de la réponse CS par le cerveau. Nous avons d’abord analysé les effets sur le cerveau de différentes cytokines pro-inflammatoires injectées dans le péritoine de souris, et avons montré que la cytokine pro-inflammatoire interleukine 1 beta (IL-1ß) est la plus efficace dans l’activation de la réponse CS. Conjointement au PVN, le noyau parabrachial (PB), qui constitue un centre important dans le tronc cérébral reliant des informations afférentes intéroceptives à des sorties métaboliques et comportementales, est fortement activé par l’IL-1ß. Nous démontrons que l’activation du PB est suffisante pour induire la réponse CS via une sous-population de neurones contrôlés par le complexe vagal (CV), et dont les neurones projettent directement dans le PVN. Nous proposons un mécanisme indépendant du nerf vague et de la voie spinoparabrachiale, par lequel les neurones du CV détectent l’IL-1ß circulant et activent le PB par le biais de cellules périvasculaires de l’area postrema (AP) produisant des prostaglandines (PGs). Parallèlement à l’AP, des cellules vasculaires leptoméningées (VLMCs) de l’éminence médiane, le système capillaire contenant les terminaisons axonales des neurones du PVN, sont aussi activées par l’IL-1ß. Nos analyses d’ARN extraits de cellules uniques ont révélé que l’activation transitoire des VLMCs par l’IL-1ß in vivo induit l’expression de médiateurs pro-inflammatoires, notamment des chimiokines et des PGs. En raison de la proximité entre les VLMCs et les terminaisons axonales des neurones du PVN contrôlant la réponse CS, les VLMCs pourraient participer au développement de la réponse CS. Ce travail de thèse montre que différentes voies cérébrales et acteurs cellulaires sont impliqués dans le contrôle de la réponse CS par les cytokines, ouvrant de nouvelles opportunités pour l’identification de cibles thérapeutiques. Ces cibles permettraient la manipulation de l’immunosuppression médiée par le cerveau dans des conditions d’infection systémique, ou, au contraire, dans le contexte de l’auto-immunité.
Lien vers HAL – tel-04069765

