Membres















À propos
Comprendre la plasticité des lymphocytes B : de la physiologie aux pathologies
L’équipe “Immunologie intégrative des lymphocytes B” étudie les mécanismes fondamentaux qui régissent les réponses immunitaires humorales en conditions normales et pathologiques. Les lymphocytes B constituent un pilier essentiel de notre système immunitaire adaptatif, responsables de la production d’anticorps neutralisants qui nous protègent contre les infections et participent à la mémoire immunologique. Leur dysfonctionnement peut conduire à des pathologies graves : transformation maligne en lymphomes B, réponses inadéquates dans le cancer, maladies autoimmunes ou déficits immunitaires. Notre approche intégrative combine développements méthodologiques innovants, découvertes fondamentales et applications translationnelles pour décrypter comment ces cellules s’adaptent aux défis immunologiques dans les conditions physiologiques et pathologiques.
L’innovation technologique au service de l’immunologie
Les lymphocytes B présentent une caractéristique unique : chaque cellule exprime un récepteur antigénique distinct, générant une diversité potentielle de 1013 spécificités différentes. Cette hétérogénéité massive nécessite des approches analytiques sophistiquées pour comprendre comment l’organisme sélectionne et amplifie les lymphocytes B exprimant les “bons” récepteurs antigéniques. Notre plateforme FB5P-seq, développée et brevetée par l’équipe, permet d’analyser simultanément l’identité moléculaire, l’état fonctionnel et la spécificité antigénique de cellules individuelles. Cette innovation technologique répond à un besoin critique de la communauté scientifique : comprendre l’hétérogénéité cellulaire dans sa complexité naturelle plutôt qu’à travers des moyennes qui masquent la diversité biologique.
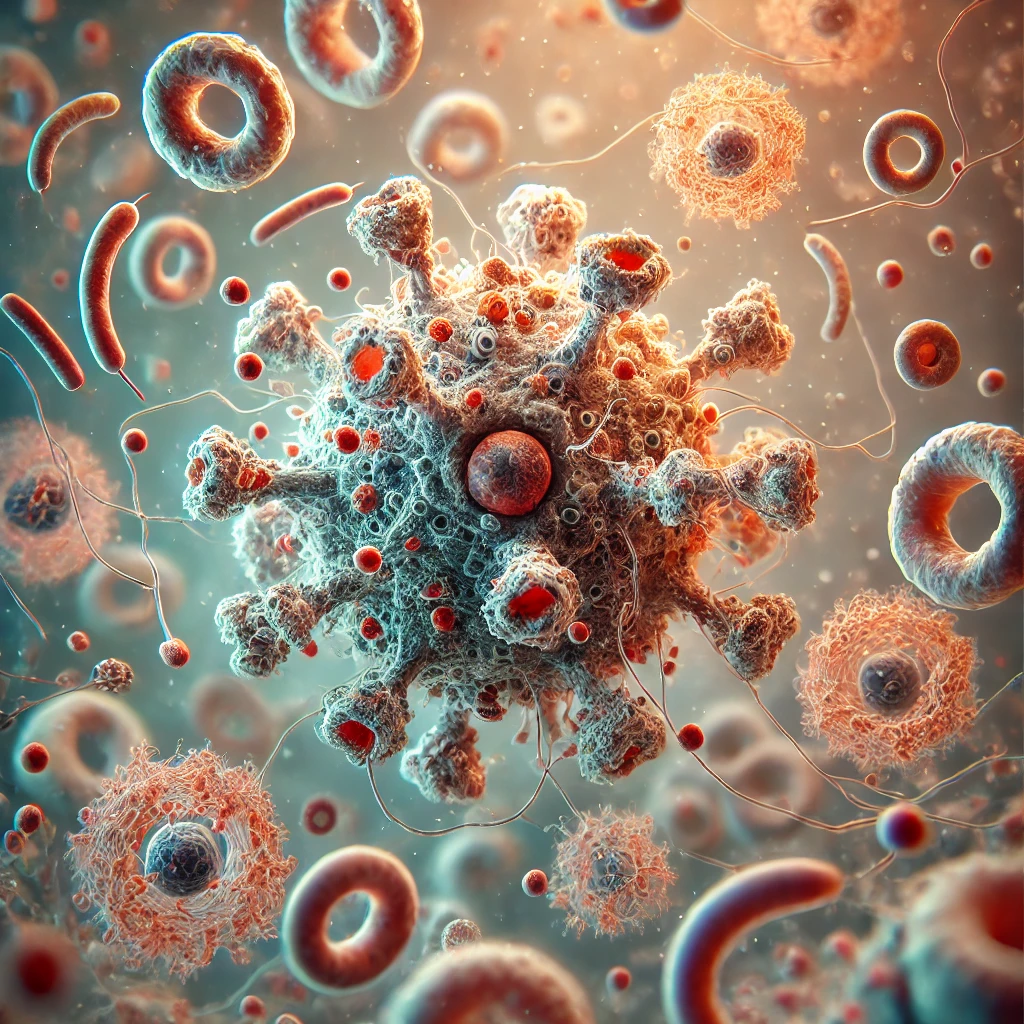
Les centres germinatifs : laboratoires naturels de l’évolution moléculaire
Au cœur de notre système immunitaire se trouvent les centres germinatifs, structures microscopiques où s’opère une véritable “évolution darwinienne” des lymphocytes B. Ces sites sont cruciaux pour expandre la diversité des récepteurs antigéniques et ainsi générer des anticorps de haute affinité lors des infections ou vaccinations. Leur dysfonctionnement contribue à l’inefficacité vaccinale et aux maladies auto-immunes, ou peut mener au développement de cancers. Nos recherches visent à comprendre les règles de cette sélection naturelle : quels critères déterminent qu’un lymphocyte B sera retenu pour devenir une cellule mémoire protectrice ? Comment les interactions moléculaires entre les lymphocytes B et leur environnement influencent-elles la sélection ? Ces questions fondamentales ont des implications directes pour l’amélioration des stratégies vaccinales et la compréhension des mécanismes impliqués dans le développement de certaines maladies auto-immunes et certains cancers.
Lymphomes : quand les cellules cancéreuses conservent leur plasticité
Les lymphomes représentent un groupe hétérogène de cancers dans lesquels les lymphocytes devenus tumoraux portent souvent les traces d’une activation immunitaire et d’un ou plusieurs passages par les centres germinatifs. En étudiant les cellules cancéreuses de différents types de lymphomes à l’aide de nos outils moléculaires à haute résolution, nos travaux dans le domaine de l’hémato-oncologie démontrent que ces cellules conservent une remarquable plasticité fonctionnelle. Cette découverte révolutionne notre compréhension de ces maladies et ouvre des perspectives thérapeutiques inédites. En caractérisant les “archétypes” cellulaires récurrents de cellules cancéreuses et en déterminant si leurs proportions sont associées à la réponse aux traitements, nos travaux contribueront au développement d’une médecine personnalisée pour les patients atteints de lymphomes.
Immunité anti-tumorale : décoder les réponses B dans le cancer
L’infiltration lymphocytaire B des tumeurs solides représente un paradoxe en immuno-oncologie : ces cellules peuvent-elles contribuer à l’immunité anti-tumorale ou facilitent-elles la progression tumorale ? Nos recherches sur le cancer du poumon, première cause de mortalité par cancer dans le monde, révèlent que les lymphocytes B infiltrant les tumeurs développent des réponses anticorps dirigées contre des auto-antigènes intracellulaires, suggérant une reconnaissance immunitaire de signaux de danger tumoraux. Cette observation pourrait expliquer pourquoi la présence de structures lymphoïdes tertiaires riches en lymphocytes B est souvent associée à un meilleur pronostic. Plus important encore, ces réponses auto-anticorps locales laissent une empreinte détectable dans la circulation sanguine, ouvrant la possibilité de développer des biomarqueurs non-invasifs pour le diagnostic précoce des cancers. Cette approche, que nous poursuivons à travers des projets collaboratifs impliquant médecins, chercheurs et industriels, pourrait transformer la détection des cancers du poumon, dans un contexte où un dépistage précoce améliorerait considérablement le pronostic des patients.
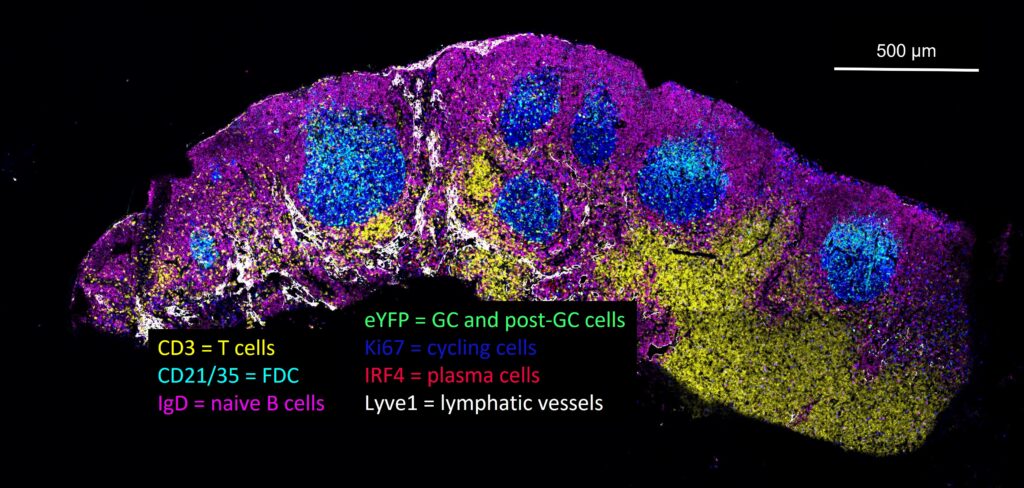
Rôle des phagocytes de la plaque de Peyer dans l’initiation de la réponse immunitaire intestinale
Groupe de recherche dirigé par le Dr Hugues Lelouard, Directeur de Recherche au CNRS.
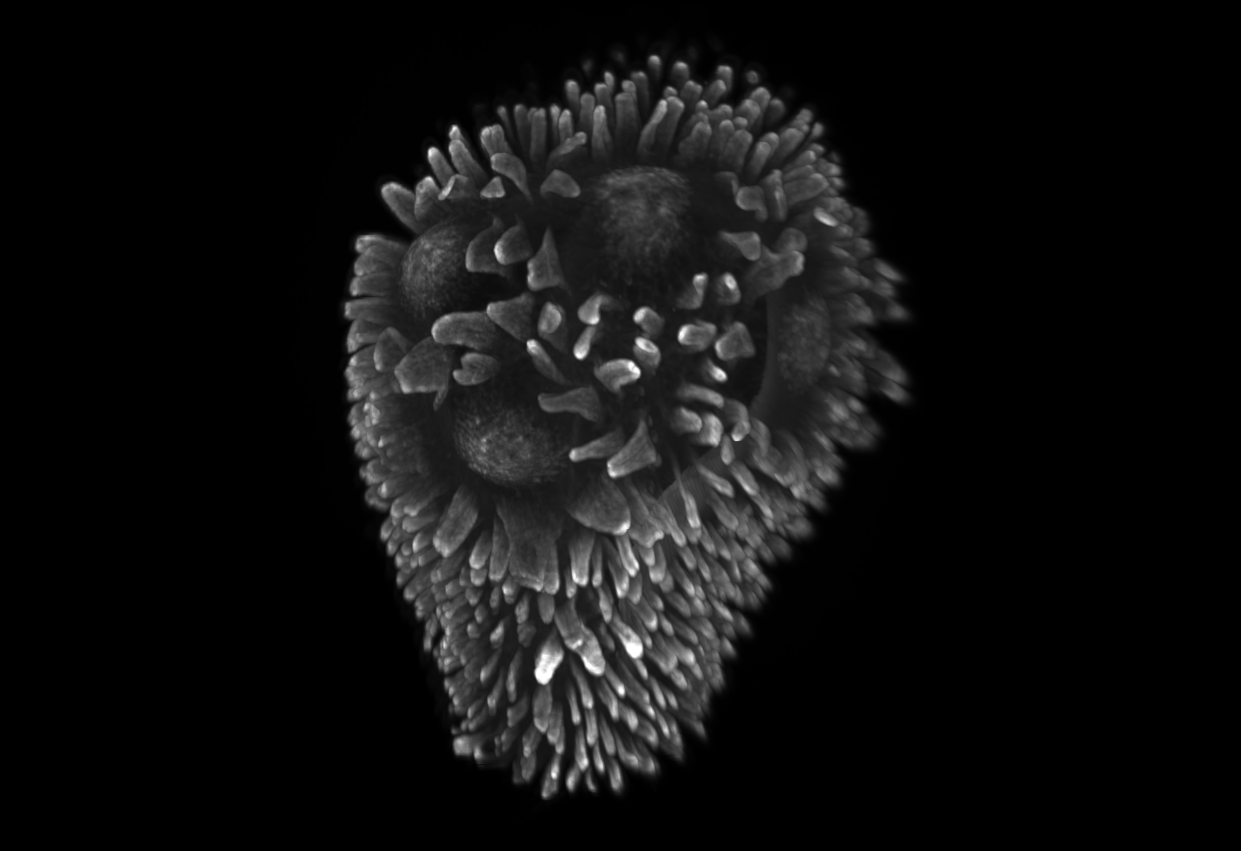
Les plaques de Peyer réparties le long de l’intestin grêle des mammifères constituent des sites sentinelles et inducteurs majeurs de l’immunité intestinale. Formées de multiples follicules de lymphocytes B formant des dômes à la surface de la muqueuse, elles jouent un rôle central dans la génération de plasmocytes sécréteurs d’IgA spécifiques de l’antigène, qui colonisent ensuite la lamina propria des villosités. Leur capacité à discriminer les agents pathogènes de la grande majorité des antigènes inoffensifs issus de l’alimentation et du microbiote, et à déclencher une réponse immunitaire adaptée, repose sur un réseau complexe de phagocytes comprenant divers sous-types de macrophages et de cellules dendritiques (DC). Après avoir effectué une caractérisation approfondie de ce système phagocytaire, nous avons étudié certaines de ses fonctions clés (capture d’antigènes, défense innée et présentation antigénique). Nos travaux ont notamment mis en évidence une nouvelle population de cellules dendritiques dérivées des monocytes, les LysoDCs, caractérisées par une forte expression de l’agent antibactérien lysozyme et par une capacité accrue de capture des bactéries entéropathogéniques. Absentes des villosités intestinales, les LysoDCs se localisent essentiellement dans la région sous-épithéliale des plaques de Peyer, où elles projettent des dendrites à travers des pores transcellulaires formés spécifiquement par les cellules M pour échantillonner directement le contenu de la lumière intestinale. Leur capacité à capturer les antigènes de la lumière intestinale mais aussi à initier une réponse lymphocytaire T auxiliaire et cytotoxique font des LysoDCs une cible de choix pour la vaccination orale. Plus récemment, nous avons élucidé les voies de différenciation, de maturation et d’activation par des adjuvants des LysoDCs, ainsi que des autres sous-populations de cellules dendritiques. Nos recherches actuelles se concentrent sur l’identification des précurseurs sanguins et des facteurs trophiques régulant la survie et la différenciation des LysoDCs (Projet LysoDiff, financé par l’ANR), ainsi que sur la mise en place de l’immunité intestinale dans les plaques de Peyer durant la période de sevrage.
Impact translationnel et perspectives d’avenir
Au-delà d’aborder des questions fondamentales sur la maturation du système immunitaire et son fonctionnement, l’approche intégrative de l’équipe, soutenue par des financements diversifiés incluant des partenariats académiques et industriels, vise à transformer les découvertes fondamentales en bénéfices cliniques tangibles. Notre participation aux projets de Recherche Hospitalo-Universitaires illustre cette démarche translationnelle, où les outils développés au laboratoire sont directement appliqués à des cohortes de patients pour identifier de nouveaux biomarqueurs diagnostiques et pronostiques. Cette stratégie s’inscrit dans une vision plus large de médecine de précision, où la caractérisation fine des réponses immunitaires individuelles permettra d’optimiser les traitements. Collaborant étroitement avec les plateformes technologiques du CIML, nous contribuons également au rayonnement de ces approches au niveau régional et national, participant à l’émergence d’un écosystème de recherche en immunologie intégrative capable de répondre aux défis contemporains de la santé humaine.
Actualités
L’Inserm annonce le financement du projet ANTIBAX à hauteur de 2,3 millions d’euros dans le cadre du programme Impact Santé […]

Le chercheur marseillais est récompensé pour ses travaux sur l’immunologie des lymphocytes B Marseille, le 2 décembre 2025 – Le […]
Projets
Notre santé repose sur un équilibre délicat entre la défense immunitaire contre les agents pathogènes et la tolérance vis à […]


Project : LYMPHOMATLAS Des études multi-omiques en cellule unique dans les lymphomes B ont permis de mettre en lumière un […]


Project : DECITIP Les cellules dendritiques plasmacytoides (pDCs) excellent dans la production des interférons de type I et III (IFN), […]


Project : ICARO Les vaccins acellulaires actuels sont surtout efficaces contre les pathogènes extracellulaires, mais échouent à induire une réponse […]


Project : PPTuft Ce projet coordonné par Philippe Jay (IGF, Montpellier) en partenariat avec notre équipe vise à déterminer le […]

Les patients atteints de lymphome folliculaire (LF) présentent une très grande hétérogénéité biologique impactant fortement la réponse aux thérapies actuelles. […]

Projet : PIONeeR Le cancer du poumon est la première cause de mortalité par cancer, avec plus de 1,5 million […]


Le projet ANTIBAX, financé par le dispositif France 2030 « Impact Santé », vise à développer des anticorps thérapeutiques ciblant les bactéries […]

Le projet TCELL-CODE, coordonné par le Dr Rémy Lasserre au Centre de Recherche en Cancérologie de Marseille vise à élucider […]


Le projet PLAIR, coordonné par le Dr Amédée Renand (CR2TI, Nantes), vise à identifier les voies moléculaires contrôlant la réponse […]

L’action structurante Spatial Omics du consortium CALYM, coordonnée par le Dr Pierre Milpied, vise à développer une plateforme virtuelle dédiée […]

Le projet de Recherche Hospitalo-Universitaire (RHU) LUCA-pi (Lung Cancer prevention and interception), coordonné par le Pr David Boulate (AP-HM), vise […]

Le projet GCselection, coordonné par le Dr Pierre Milpied (CIML), revisite les mécanismes de maturation des anticorps dans les centres […]


L’action structurante ST-omics du Cancéropôle de la Région Sud est co-coordonnée par le Dr Pierre Milpied (CIML), le Pr Emmanuelle […]

Le projet AITLas-Impact, coordonné par Pierre Milpied (CIML) en collaboration avec le Pr François Lemonnier (Institut Mondor de Recherche Biomédicale, […]

L’équipe du Dr Pierre Milpied au CIML participe à un projet collaboratif coordonné par le Dr Jean-Pierre de Villartay (Institut […]